Panas, bahang, atau kalor adalah energi yang berpindah akibat perbedaan suhu. Satuan SI untuk panas adalah joule.
Panas bergerak dari daerah bersuhu tinggi ke daerah bersuhu rendah. Setiap benda memiliki energi dalam yang berhubungan dengan gerak acak dari atom-atom atau molekul penyusunnya.
Energi dalam ini berbanding lurus terhadap suhu benda. Ketika dua benda dengan suhu berbeda bergandengan, mereka akan bertukar energi internal sampai suhu kedua benda tersebut seimbang. Jumlah energi yang disalurkan adalah jumlah energi yang tertukar. Kesalahan umum untuk menyamakan panas dan energi internal. Perbedaanya adalah panas dihubungkan dengan pertukaran energi internal dan kerja yang dilakukan oleh sistem. Mengerti perbedaan ini dibutuhkan untuk mengerti hukum pertama termodinamika.
Radiasi inframerah sering dihubungkan dengan panas, karena objek dalam suhu ruangan atau di atasnya akan memancarkan radiasi kebanyakan terkonstentrasi dalam "band" inframerah-tengah. (lihat badan hitam).
Jumlah panas, kecepatan penyaluran panas, dan flux panas semua dinotasikan dengan perbedaan permutasi huruf Q. Mereka biasanya diganti dalam konteks yang berbeda.
Jumlah panas dinotasikan sebagai Q, dan diukur dalam joule dalam satuan SI.
Flux panas didefinisikan sebagai jumlah panas per satuan waktu per luas area, dan dinotasikan q, dan diukur dalam watt per meter2. Juga biasanya dinotasikan sebagai Q″ atau q″ atau
Kapasitas panas molar dapat "dimodifikasi" bila perubahan suhu terjadi pada volume tetap atau tekanan tetap. Bila tidak, menggunakan hukum pertama termodinamika dikombinasikan dengan persamaan yang menghubungkan energi internal gas tersebut terhadap suhunya.
Panas bergerak dari daerah bersuhu tinggi ke daerah bersuhu rendah. Setiap benda memiliki energi dalam yang berhubungan dengan gerak acak dari atom-atom atau molekul penyusunnya.
Energi dalam ini berbanding lurus terhadap suhu benda. Ketika dua benda dengan suhu berbeda bergandengan, mereka akan bertukar energi internal sampai suhu kedua benda tersebut seimbang. Jumlah energi yang disalurkan adalah jumlah energi yang tertukar. Kesalahan umum untuk menyamakan panas dan energi internal. Perbedaanya adalah panas dihubungkan dengan pertukaran energi internal dan kerja yang dilakukan oleh sistem. Mengerti perbedaan ini dibutuhkan untuk mengerti hukum pertama termodinamika.
Radiasi inframerah sering dihubungkan dengan panas, karena objek dalam suhu ruangan atau di atasnya akan memancarkan radiasi kebanyakan terkonstentrasi dalam "band" inframerah-tengah. (lihat badan hitam).
Notasi
Ketika suatu benda melepas panas ke sekitarnya, Q < 0. Ketika benda menyerap panas dari sekitarnya, Q > 0.Jumlah panas, kecepatan penyaluran panas, dan flux panas semua dinotasikan dengan perbedaan permutasi huruf Q. Mereka biasanya diganti dalam konteks yang berbeda.
Jumlah panas dinotasikan sebagai Q, dan diukur dalam joule dalam satuan SI.
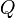 adalah banyaknya kalor (jumlah panas) dalam joule
adalah banyaknya kalor (jumlah panas) dalam joule adalah massa benda dalam kg
adalah massa benda dalam kg adalah kalor jenis dalam joule/kg °C, dan
adalah kalor jenis dalam joule/kg °C, dan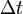 adalah besarnya perubahan suhu dalam °C.
adalah besarnya perubahan suhu dalam °C.
Flux panas didefinisikan sebagai jumlah panas per satuan waktu per luas area, dan dinotasikan q, dan diukur dalam watt per meter2. Juga biasanya dinotasikan sebagai Q″ atau q″ atau
Perubahan suhu
Jumlah energi panas, ΔQ, dibutuhkan untuk menggantu suhu suatu material dari suhu awal, T0, ke suhu akhir, Tf tergantung dari kapasitas panas bahan tersebut menurut hubungan:- Cp = mcs
- Cp = ncn.
Kapasitas panas molar dapat "dimodifikasi" bila perubahan suhu terjadi pada volume tetap atau tekanan tetap. Bila tidak, menggunakan hukum pertama termodinamika dikombinasikan dengan persamaan yang menghubungkan energi internal gas tersebut terhadap suhunya.











0 komentar:
Posting Komentar